Hypervalenz
Als Hypervalenz [griech. hyper: über, zu viel, siehe Liste griechischer Präfixe] wird die positive Abweichung zur Valenzstrukturtheorie bezeichnet, nach der die äußere Schale eines Atoms mehr als die nach der Edelgaskonfiguration von s- und p-Orbitalen möglichen acht Elektronen aufnehmen kann (Oktettregel). Sie tritt bei Verbindungen von schweren Hauptgruppenelementen der 3. bis 8. Hauptgruppe mit starken Elektronenakzeptoren wie Sauerstoff oder Fluor auf.[1] So zum Beispiel in Selenhalogeniden wie Selenhexafluorid (SeF6) oder Iodfluoriden (z. B. IF5, IF7), generell in vielen Edelgas- und Interhalogenverbindungen. Es wurde eine Beteiligung der d-Orbitale des Zentralatoms angenommen, was allerdings inzwischen als nicht korrekt gilt. Heutzutage wird die Beschreibung durch eine elektronenreiche Mehrzentrenbindung realisiert.
Beispiele[Bearbeiten | Quelltext bearbeiten]
Hypervalente Iodverbindungen[Bearbeiten | Quelltext bearbeiten]
In der organischen Synthesechemie werden hypervalente Iodverbindungen als milde Oxidationsmittel vielfach eingesetzt. Zu diesen „modernen“ Oxidationsmitteln zählen u. a:
| Iodosylbenzol[2][3] | Di-acetoxy-iodbenzol (DIB)[2][3][4] | Dess-Martin-Periodinan (DMP)[2][3] | 2-Iodoxybenzoesäure (IBX)[2][3][4] |
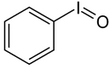 |
 |
 |
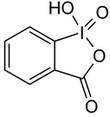
|
Dess-Martin-Periodinan wird besonders in der so genannten Dess-Martin-Oxidation eingesetzt. Weiterhin gibt es Reagenzien mit hypervalentem Iod, die zur elektrophilen Einführung von Iod (Angriff von I+ auf Nucleophile, z. B. C=C-Doppelbindungen) dienen:
| Di-sym-collidin-iodoniumperchlorat[5] |

|
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu hypervalency. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.HT07054 – Version: 2.3.2.
- ↑ a b c d V. V. Zhdankin, P. J. Stang: In: Chemical Reviews. 102, 2002, S. 2523–2584.
- ↑ a b c d T. Wirth: In: Angew. Chem. 117, 2005, S. 3722–3731.
- ↑ a b R. D. Richardson, T. Wirth: In: Angew. Chem. 118, 2006, S. 4510–4512.
- ↑ D. A. Griffith, S. J. Danishefsky: In: J. Am. Chem. Soc. 112, 1990, S. 5811–5819.