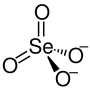
Kaliumselenat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kaliumselenat | |||||||||||||||
| Andere Namen |
Kaliumorthoselenat | |||||||||||||||
| Summenformel | K2SeO4 | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 221,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
3,07 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
114 g/l bei 25 °C[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−1110 kJ·mol−1 [5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Kaliumselenat ist eine anorganische chemische Verbindung des Kaliums aus der Gruppe der Selenate.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Kaliumselenat kann man gewinnen, indem man Selendioxid mit einer gekühlten Kaliumhydroxidlösung reagieren lässt und das so gewonnene Kaliumselenit mit Brom im alkalischen Milieu oxidiert.[6]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Kaliumselenat ist ein weißer geruchloser Feststoff, der löslich in Wasser ist.[1] Von der Verbindung sind vier Modifikationen bekannt und besitzt bei Raumtemperatur eine orthorhombische Kristallstruktur mit der Raumgruppe Pnma (Raumgruppen-Nr. 62). Bei niedrigen Temperaturen unter 93 K liegt er in einer anderen, ferroelektrischen Modifikation vor (Raumgruppe Pna21 (Nr. 33)).[7] Bei einer Temperatur über 745 K geht er in eine hexagonale Kristallstruktur mit der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) über.[8][2][9]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Kaliumselenat kann zur Herstellung von Selentrioxid verwendet werden.[10] Kaliumselenat wurde auch zur Behandlung von Selenmangel bei Nutztieren verwendet.[11][12]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Datenblatt Potassium selenate bei Alfa Aesar, abgerufen am 15. Juni 2016 (Seite nicht mehr abrufbar).
- ↑ a b Evgenii Tonkov: High Pressure Phase Transformations A Handbook. CRC Press, 1992, ISBN 978-2-88124-759-0, S. 518 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Inorganic Compounds, S. 4-83.
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Selenverbindungen mit Ausnahme von Cadmiumsulfoselenid, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. Januar 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ M. Binnewies, E. Mike: Thermochemical Data of Elements and Compunds. 2. Auflage. Wiley-VCH, Weinheim 2002, ISBN 3-527-30524-6, Kap. 5, S. 645.
- ↑ Irene Rosenfeld, Orville A. Beath: Selenium Geobotany, Biochemistry, Toxicity, and Nutrition. Academic Press, 2013, ISBN 978-1-4832-7590-1, S. 305 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ N. Yamada, Y. Ono, T. Ikeda: A Structural Study of the Incommensurate-to-Ferroelectric Phase Transition in K2SeO4. In: Journal of the Physical Society of Japan, 53, 1984, S. 2565–2574, doi:10.1143/JPSJ.53.2565.
- ↑ N. Ohama: Superstructure of potassium selenate K2SeO4. In: Materials Research Bulletin. 9, 1974, S. 283, doi:10.1016/0025-5408(74)90078-6.
- ↑ A. Kálmán, J. S. Stephens, D. W. J. Cruickshank: The crystal structure of K2SeO4. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 26, S. 1451, doi:10.1107/S0567740870004314.
- ↑ Hermann Sicius: Chalkogene: Elemente der sechsten Hauptgruppe Eine Reise durch das Periodensystem. Springer-Verlag, 2015, ISBN 978-3-658-10522-8, S. 28 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ und Nutztieren: Begründet von W. Löscher, F.R ...: Pharmakotherapie bei Haus- und Nutztieren Begründet von W. Löscher, F.R. Ungemach und R. Kroker. Georg Thieme Verlag, 2014, ISBN 3-8304-1252-5 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Kaliumselenat bei Vetpharm, abgerufen am 15. Juni 2016.




