Mycomycin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
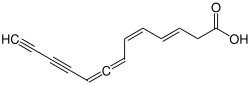
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Mycomycin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C13H10O2 | ||||||||||||
| Kurzbeschreibung |
farblose Nadeln[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 198,22 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Schmelzpunkt |
75 °C (explosionsartige Zersetzung)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Mycomycin ist ein natürlich vorkommendes Antibiotikum. Es ist eine stark ungesättigte Carbonsäure, welche zwei konjugierte Doppelbindungen und zwei konjugierte Dreifachbindungen aufweist. Zudem enthält sie zwei kumulierte Doppelbindungen; es handelt sich demnach um ein Allen. Sie zählt außerdem zu den Eninen, Diinen und Polyenen, sowie Alken- und Alkinsäuren.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Mycomycin kommt in dem Bakterium Nocardia acidophilus vor und war das erste chirale Allen, das in der Natur nachgewiesen wurde.[2][4]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Mycomycin ist ein Antibiotikum, das gegen Mycobacterium tuberculosis und verschiedene pathogene Pilze wirkt. Die Verbindung ist sehr instabil und zersetzt sich schnell, wenn sie nicht sehr kalt (z. B. auf Trockeneis) oder als verdünnte Lösung unter Inertgas gelagert wird. Bei Erhitzen in einer abgeschmolzenen Kapillare unter Stickstoff zersetzt es sich bei 75 °C explosionsartig.[2] Durch seine Allen-Substruktur ist es chiral und optisch aktiv (linksdrehend), mit einem Drehwinkel von .[1] Das Zentralatom im Allen trennt auch die beiden konjugierten Mehrfachbindungssysteme voneinander, was Einfluss auf die spektroskopischen Eigenschaften hat.[2][1]
Reaktionen[Bearbeiten | Quelltext bearbeiten]
Durch Reaktion mit verdünntem Kaliumhydroxid bei 27 °C lagert sich Mycomycin zu Isomycomycin um.[1] Dabei kommt es zu einer Isomerisierung der Allenstruktur zu einer Dreifachbindung, zu einer Verschiebung der schon vorhandenen Dreifachbindungen und zu einer Isomerisierung der Z-Doppelbindung zu einer E-Doppelbindung.[2] Die Isomerisierung funktioniert analog auch mit Lithiumhydroxid oder Natriumhydroxid.[5]
Durch Umsetzung mit Kaliumpermanganat oder Natriumdichromat entsteht ein schwarzes polymeres Harz. Hydrierung ergibt Tridecansäure.[2]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Walter D. Celmer, I. A. Solomons: The Structure of the Antibiotic Mycomycin. In: Journal of the American Chemical Society. Band 74, Nr. 7, April 1952, S. 1870–1871, doi:10.1021/ja01127a529.
- ↑ a b c d e f Walter D. Celmer, I. A. Solomons: Mycomycin. I. Isolation, Crystallization and Chemical Characterization. In: Journal of the American Chemical Society. Band 74, Nr. 9, Mai 1952, S. 2245–2248, doi:10.1021/ja01129a024.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Walter D. Celmer, I. A. Solomons: Mycomycin. III. The Structure of Mycomycin, an Antibiotic Containing Allene, Diacetylene and cis, trans-Diene Groupings 1. In: Journal of the American Chemical Society. Band 75, Nr. 6, März 1953, S. 1372–1376, doi:10.1021/ja01102a031.
- ↑ Walter D. Celmer, I. A. Solomons: Mycomycin. II. The Structure of Isomycomycin, an Alkali-Isomerization Product of Mycomycin 1,2. In: Journal of the American Chemical Society. Band 74, Nr. 15, August 1952, S. 3838–3842, doi:10.1021/ja01135a037.
![{\displaystyle \left[\alpha \right]_{\text{D}}^{25}=-130^{\circ }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5af59339cf4241246c612442ac43b08b058c05a7)