Nitrosylkation

Das Nitrosylkation ist das durch Oxidation von Stickstoffmonoxid entstandene Ion.[1] Andere Schreibweisen oder Bezeichnungen sind auch Nitrosyl-Kation und Nitrosoniumion.[2] Es ist ein Teilchen, welches in einigen Salzen vorkommt und in mehreren chemischen Reaktionen auftritt.[1] NO+ ist isoelektronisch zu CO, CN− und N2.
Vorkommen und Entstehung[Bearbeiten | Quelltext bearbeiten]
Das Nitrosyl-Kation kann für Reaktionen zum Beispiel aus Nitrosylchlorid, Nitrosylschwefelsäure und Nitrosyltetrafluoroborat gewonnen werden.[1]
-
Nitrosylchlorid
-
Nitrosylschwefelsäure
-
Nitrosyltetrafluoroborat
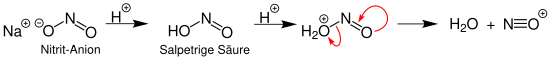
Eine Möglichkeit zur Gewinnung eines Nitrosylkations stellt die saure Behandlung eines Nitrits dar:
Hier nimmt das Nitrit-Anion in zwei Schritten ein Proton auf. Anschließend teilt sich das entstandene Molekül, sodass Wasser und das Nitrosylkation entstehen.[2]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Das Nitrosylkation spielt in mehreren Reaktionen eine Rolle.
Diazotierung[Bearbeiten | Quelltext bearbeiten]
Für die Diazotierung ist das elektrophile Nitrosylkation das entscheidende Reagenz:

Nitrosierung[Bearbeiten | Quelltext bearbeiten]
Das Nitrosylkation spielt in der Nitrosierung von N-monosubstituierten Säureamiden die entscheidende Rolle, bei der N-Nitrosamide entstehen:

Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Jürgen Falbe, Manfred Regitz: Römpp Chemie Lexikon. 9. Auflage. Georg Thieme Verlag, Stuttgart 1990, ISBN 3-13-735009-3, S. 3028.
- ↑ a b Jonathan Clayden, Nick Greeves, Stuart Warren: Organische Chemie. 2. Auflage. Springer Spektrum, Berlin Heidelberg 2013, ISBN 978-3-642-34715-3, S. 513.