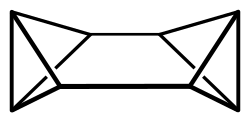
Octabisvalen
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Octabisvalen | |||||||||
| Andere Namen |
Pentacyclo[5.1.0.02,4.03,5.06,8]octan (IUPAC) | |||||||||
| Summenformel | C8H8 | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 104,15 g·mol−1 | |||||||||
| Aggregatzustand |
fest[1] | |||||||||
| Schmelzpunkt |
27–30 °C[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Octabisvalen ist eine chemische Verbindung aus der Gruppe der gesättigten polycyclischen Kohlenwasserstoffe. Neben Cuban und Cunean ist Octabisvalen ein Vertreter der drei möglichen gesättigten C8H8-Kohlenwasserstoffe und ein Valenzisomer von Cyclooctatetraen.[3][4]
Darstellung[Bearbeiten | Quelltext bearbeiten]
Die Darstellung der ersten Verbindung mit einer Octabisvalenstruktur wurde 1985 von Christoph Rücker und Horst Prinzbach publiziert.[4] In einer ursprünglich elfstufigen Synthesesequenz, die auf acht Stufen verkürzt werden konnte, sind präparativ brauchbare Mengen (Z)-3,7-Bis(phenylsulfonyl)octabisvalen zugänglich:[5]
Durch Umsetzung von syn-Benzoltrioxid 2 mit Methylphenylsulfon[6] 1 und n-Butyllithium erhält man in fast quantitativer Ausbeute ein intramolekular cyclisiertes Bisadditionsprodukt 3, das im Folgeschritt mit Aceton in Gegenwart von p-Toluolsulfonsäure zum Acetal 4 umgesetzt wird. Die verbliebene Hydroxygruppe wird mit Methansulfonsäurechlorid in das Mesylat 5 überführt, das mit n-Butyllithium und Diisopropylamin in THF zum Zwischenprodukt 6 cyclisiert. Nach dem Abspalten der Schutzgruppe mit Salzsäure in Methanol zum Diol 7 werden die beiden Hydroxygruppen mit Benzolsulfonsäurechlorid in Gegenwart von Triethanolamin in den Benzolsulfonsäureester überführt. Zwischenprodukt 8 wird mit n-Butyllithium in THF zur tetracyclischen Verbindung 9 umgesetzt, die mit Kaliumhydroxid in DMSO zum (Z)-3,7-Bis(phenylsulfonyl)octabisvalen 10 cyclisiert.[7]
Die Darstellung des unsubstituierten Octabisvalen durch Umsetzung von (Z)-3,7-Bis(phenylsulfonyl)octabisvalen mit Natrium in flüssigem Ammoniak wurde 1987 beschrieben.[1] Als weitere Variante gelingt die Darstellung der Verbindung durch eine analoge Umsetzung eines cyanosubstiturierten Octabisvalen, das sich wiederum in einer fünfstufigen Reaktion aus Tricyclo[4.1.0.00,7]hept-4-en-3-on[8] herstellen lässt.[9]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Das Octabisvalenmolekül besitzt eine D2h-Symmetrie und weist mit den beiden Bicyclo[1.1.0]butan-Einheiten eine hohe Ringspannung auf. Die MM2-Kraftfeldrechnung von Octabisvalen ergibt eine Ringspannungsenergie von 644 kJ/mol, ein Wert der zwischen der Ringspannung von Cuban (694 kJ/mol) und Cunean (571 kJ/mol) liegt. Bis zu einer Temperatur von 140 °C ist Octabisvalen thermisch inert.[1]
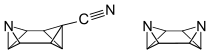
Nach der IUPAC-Nomenklatur kann bei Octabisvalen nicht zwischen der 7- und der 8-Position unterschieden werden. Daraus folgt, dass es für 3,7-disubstituierte Octabisvalenderivate zwei Stereoisomere gibt, für die in Anlehnung an die (Z)/(E)-Isomerie bei den Alkenen ebenfalls die Bezeichnung (Z)- und (E)-Isomer vorgeschlagen wurde.[10]
1991 wurde die Synthese von heterocyclischen Octabisvalenen, dem (Z)-7-Cyano-3-azaoctabisvalen und dem (Z)-3,7-Diazaoctabisvalen, veröffentlicht.[11]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Christoph Ruecker, Bjoern Trupp: Pentacyclo[5.1.0.02,4.03,5.06,8]octane (octabisvalene). In: Journal of the American Chemical Society. Band 110, Nr. 14, 1988, S. 4828–4829, doi:10.1021/ja00222a051.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Nadia El-Karzazi, Markus Möbs, Peter Hilmi Rösch: Octabisvalen - Art or Science? (PDF) 31. Januar 2007, abgerufen am 27. Juli 2022.
- ↑ a b Christoph Rücker, Horst Prinzbach: (Z)-3,7-Bis(phenylsulfonyl)pentacyclo-[5.1.0.02,4.03,5.06,8]octan, ein Octabisvalen-Derivat. In: Angewandte Chemie. Band 97, Nr. 5, 1985, S. 426–427, doi:10.1002/ange.19850970529.
- ↑ Christoph Rücker, Horst Prinzbach, Hermann Irngartinger, Reiner Jahn, Hans Rodewald: (Z)-3,7-bisphenylsulfonyl-octabisvalene improved synthesis and X-ray structure analysis. In: Tetrahedron Letters. Band 27, Nr. 14, 1986, S. 1565–1568, doi:10.1016/S0040-4039(00)84314-2.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Methylphenylsulfon: CAS-Nummer: 3112-85-4, EG-Nummer: 221-476-8, ECHA-InfoCard: 100.019.524, PubChem: 18369, ChemSpider: 17347, Wikidata: Q27251665.
- ↑ Christoph Rücker: Phenylsulfonylsubstituierte Octabisvalene, Synthesen und Reaktionen. In: Chemische Berichte. Band 120, Nr. 10, 1987, S. 1629–1644, doi:10.1002/cber.19871201006.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Tricyclo[4.1.0.0(2,7)]hept-4-en-3-on: CAS-Nummer: 58987-16-9, PubChem: 11105325, ChemSpider: 9280461, Wikidata: Q82277203.
- ↑ Björn Trupp, Dirk‐Rainer Handreck, Hans‐Peter Böhm, Lothar Knothe, Hans Fritz, Horst Prinzbach: Funktionalisierte Octabisvalene. In: Chemische Berichte. Band 124, Nr. 8, 1991, S. 1757–1775, doi:10.1002/cber.19911240814.
- ↑ Christoph Rücker,Gunter Haftstein: E/Z Isomerism Without a Double Bond – an Unusual Type of Stereoisomerism, and an Unprecedented Isomerisation in a Bicyclobutane. In: Croatica Chemica Acta. Band 77, Nr. 1–2, 2004, S. 237–241 (srce.hr).
- ↑ Björn Trupp, Hans Fritz, Horst Prinzbach, Hermann Irngartinger, Uwe Reifenstahl: 3‐Aza‐ und syn ‐3,7‐Diazaoctabisvalen Synthesen, Röntgenstrukturanalysen, neue Heterocyclen. In: Chemische Berichte. Band 124, Nr. 8, 1991, S. 1777–1794, doi:10.1002/cber.19911240815.