Peroxyoxalat-Chemilumineszenz
Die Peroxyoxalat-Chemilumineszenz, auch als PICL (Abk. für Peroxyoxalat-initiierte Chemilumineszenz) bezeichnet, ist eine chemische Reaktion von Wasserstoffperoxid mit Derivaten der Oxalsäure, bei der Licht emittiert wird, wenn fluoreszenzfähige Verbindungen zugegen sind.
Entdeckung[Bearbeiten | Quelltext bearbeiten]
In den Bell Laboratories entdeckte Edwin A. Chandross zu Beginn der 1960er Jahre, dass bei der Reaktion von Wasserstoffperoxid und Oxalylchlorid in wässrigen Lösungsmittelgemischen ein schwaches, bläulich-weißes Leuchten (Lumineszenz) auftritt. Die bei der heftigen Reaktion entstehenden Gase brachten ein mit Anthracen imprägniertes Filterpapier zum Fluoreszieren. Wurde die Umsetzung der Reaktanten in Gegenwart von gelöstem Anthracen durchgeführt, so trat eine helle Lumineszenz auf, die dem Fluoreszenzlicht dieser Verbindung entsprach. 9,10-Diphenylanthracen und N-Methylacridon wurden ebenfalls zum Fluoreszieren angeregt.[1]
Reaktionsmechanismen[Bearbeiten | Quelltext bearbeiten]
Wasserstoffperoxid und Oxalylchlorid sind bifunktionelle Edukte, haben daher prinzipiell die Möglichkeit, Oligomere zu bilden. Die Natur der auftretenden Zwischenstufen war lange Zeit umstritten. Über den ersten Schritt der Reaktion besteht kein Zweifel: In Analogie zur Hydrolyse von Carbonsäurechloriden wird Chlorwasserstoff freigesetzt, und eine Peroxysäure (Chlorcarbonylperameisensäure) gebildet. Diese soll zu Kohlenmonoxid, Sauerstoff und Chlorwasserstoff zerfallen.[1] Da jedoch die Peroxysäure noch das Strukturelement eines Carbonsäurechlorids enthält, kann als Folgereaktion die Bildung von Diperoxyoxalsäure diskutiert werden. In Gegenwart von Wasser könnte auch Monoperoxyoxalsäure gebildet werden.

Schließlich könnte durch intramolekularen nukleophilen Angriff der HO-Gruppe auf das Cl-C=O-Kohlenstoffatom auch das Vierring-Molekül 1,2-Dioxetandion entstehen. Trotz langem Suchen nach diesem vermuteten, labilen Intermediat gelang erst in neuerer Zeit durch Markierung des Oxalylchlorids mit 13C-Isotopen der Nachweis, dass bei der Reaktion mit Wasserstoffperoxid 1,2-Dioxetandion auftritt.[2][3]
Sicherlich konkurrieren bei der Umsetzung von Oxalylchlorid mit Wasserstoffperoxid mehrere Reaktionen. Welche der reaktiven Zwischenstufen („Schlüsselintermediat“, High-Energy Intermediate, HEI) die Chemilumineszenz bewirkt, ist umstritten; 1,2-Dioxetandion, atomarer Sauerstoff und elektronisch angeregtes Kohlendioxid (im Singulettzustand) wurden in Betracht gezogen.[4] Dabei ist zu berücksichtigen, dass das HEI flüchtig sein muss, weil es auch in der Gasphase aktiv ist. Möglicherweise sind aber in Lösung und in der Gasphase verschiedene Moleküle für die Auslösung der Lumineszenz verantwortlich.
Oxalsäure-diarylester[Bearbeiten | Quelltext bearbeiten]
Chandross’ Entdeckung war der Anstoß zu einer umfassenden Untersuchung des Lumineszenz-Phänomens mit weiteren Derivaten der Oxalsäure in den Laboratorien der American Cyanamid unter der Leitung von M. M. Rauhut.[5] Anstelle des aggressiven, mit Wasser heftig reagierenden Oxalylchlorids wurde Oxalsäurediphenylester (Diphenyloxalat) studiert. Damit wird die Bildung von Salzsäure vermieden, jedoch kann die Phenoxy-Gruppe als relativ gute Fluchtgruppe ebenfalls die Acylierung des Wasserstoffperoxids möglich machen. Auf dieser Idee basiert die Entwicklung des Peroxyoxalat-Systems, welches sich als eines der effizientesten Chemilumineszenz-Prozesse erwiesen hat. In Analogie zur Perhydrolyse des Oxalylchlorids (siehe oben) wurde angenommen, dass im ersten Reaktionsschritt Peroxyoxalsäurephenylester (Phenyl-peroxyoxalat) entsteht. In einer intramolekularen Ringschluss-Reaktion könnte dieses Primärprodukt zu 1,2-Dioxetandion cyclisieren.

Der Arbeitsgruppe um W. J. Baader (Universität Sao Paulo) gelang es, ein Derivat des o. g. Primärproduktes zu synthetisieren: 4-Chlorphenyl-peroxyoxalat.[6] Das Studium dieser labilen Verbindung hatte das überraschende Ergebnis, dass für die Chemilumineszenz in Gegenwart fluoreszierender Verbindungen ein Zusatz von Basen notwendig ist. Die Peroxysäure selbst, d. h. 4-Chlorphenyl-peroxyoxalat, kann daher für die Lichtemission nicht verantwortlich sein. Daher wurde postuliert, dass die Peroxysäure durch Basen deprotoniert wird und das Anion Ringschluss zu 1,2-Dioxetandion erleidet.[7] Dieses soll die Lumineszenz bewirken, doch ist damit noch nicht erklärt, wie aus dem Molekül im Grundzustand ein elektronisch angeregter Zustand entsteht. Es wurde postuliert, dass elektronisch angeregte CO2-Moleküle im Singulettzustand ihre Energie auf fluoreszenzfähige Moleküle (Fluorophore, Fluoreszer) wie Anthracen übertragen. Diese werden elektronisch angeregt und emittieren bei der Rückkehr in den Grundzustand je ein Lichtquant. Man kann diesen Fall als Beispiel einer sensibilisierten Chemilumineszenz klassifizieren.[4] Kinetische Untersuchungen machen jedoch einen komplizierteren Mechanismus wahrscheinlich, der auch für andere organische Peroxide postuliert wird.[8] Zur genaueren Aufklärung des Reaktionsmechanismus wurden in der Arbeitsgruppe von J. W. Birks mit Hilfe eines Fluoreszenzspektrometers, angeschlossen an eine Stopp-flow-Reaktionszelle, Untersuchungen zur Reaktionskinetik durchgeführt.[9] Das Schlüsselintermediat (HEI) oder dessen angeregtes Bruchstück gibt seine Energie nicht direkt an die fluoreszierende Komponente ab, sondern diese greift aktiv in den Prozess ein; sie wirkt als Chemilumineszenz-Aktivator (ACT).[10] Im Einzelnen kann man folgendes Bild entwerfen:

Zunächst entsteht ein Encounter Complex aus dem Schlüsselintermediat (z. B. Dioxetandion) und dem ACT (z. B. Anthracen). Vom ACT wird nun ein Elektron auf das Peroxid übertragen; es resultiert ein Paar aus Radikalanion und Radikalkation. Dabei wird die O-O-Bindung des Peroxids geschwächt, was schließlich zum Bruch der Bindung führt. Aus dem Radikalanion-Teil wird CO2 eliminiert. In dem neuen Radikalpaar wird das Elektron auf den ACT-Radikalkation-Teil zurückübertragen, der in den elektronisch angeregten Zustand (ACT*) übergeht. Dieser emittiert das Fluoreszenzlicht. Der ganze Prozess wird als chemisch initiierte Elektronen-Austausch-Lumineszenz bezeichnet (CIEEL, englisch Chemically Initiated Electron Exchange Luminescence).[8]
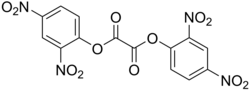
Schon vor Baaders Untersuchung wurde gefunden, dass eine Variation des Phenylrestes durch Substitution mit weiteren Chlor-, Nitro- und anderen Gruppen eine Steigerung der Lichtausbeute brachte. Besonders geeignete Arylester sind Bis(2,4-dinitrophenyl)oxalat (DNPO) und Bis(2,4,6-trichlorphenyl)oxalat (TCPO). Die Aryloxygruppen dieser „aktivierten Ester“ sind noch bessere Fluchtgruppen und dürften daher sowohl den nukleophilen Angriff des Wasserstoffperoxids auf die Carbonylgruppen des Diaryloxalats als auch die postulierte Cyclisierung zum 1,2-Dioxetandion begünstigen.
Anwendungen[Bearbeiten | Quelltext bearbeiten]
Peroxyoxalat-Chemilumineszenzsysteme werden als Leuchtmittel eingesetzt, z. B. in Leuchtstäben. Auch in der Analytik finden sie Verwendung.[11][12] Wegen der hohen Quantenausbeute und hohen Selektivität eignet sich diese Reaktion für die HPLC-Detektion von amino-substituierten polycyclischen aromatischen Kohlenwasserstoffen. Außerdem kann sie angewandt werden für die Detektion von Wasserstoffperoxid bzw. von Hydroxylradikalen, die als reaktive Moleküle in der Erdatmosphäre besonders von Bedeutung sind.[13] Porphyrine lassen sich im Harn und in den Fäces durch den PCL-Test nach Brandl und Albrecht nachweisen, was für die Diagnose einiger Stoffwechselkrankheiten (Porphyrien) nützlich ist.[14][15]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Wilhelm J. Baader, C. V. Stevani,. Erick L. Bastos, Chemiluminescence of Organic Peroxides. Patai's Chemistry of Functional Groups. Wiley, 2009. doi:10.1002/9780470682531.pat0362
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Edwin A. Chandross: A new chemiluminescent system. In: Tetrahedron Letters. Band 4, Nr. 12, Januar 1963, doi:10.1016/s0040-4039(01)90712-9.
- ↑ Richard Bos, Neil W. Barnett, Gail A. Dyson, Kieran F. Lim, Richard A. Russell, Simon P. Watson,,Studies on the mechanism of the peroxyoxalate chemiluminescence reaction: Part 1. Confirmation of 1,2-dioxetanedione as an intermediate using 13C nuclear magnetic resonance spectroscopy, Analytica Chimica Acta 502, 2004, S. 2141–147. doi:10.1016/j.aca.2003.10.014
- ↑ Sarah A.Tonkin, Richard Bos, Gail A. Dyson, Kieran F. Lim, Richard A. Russell, Simon P. Watson, Christopher M. Hindson, Neil W. Barnett, Studies on the mechanism of the peroxyoxalate chemiluminescence reaction: Part 2. Further identification of intermediates using 2D EXSY 13C nuclear magnetic resonance spectroscopy, Analytica Chimica Acta 614, 2008, S. 2173–181. doi:10.1016/j.aca.2008.03.009
- ↑ a b Herbert Brandl, Chemolumineszenz, in: Dieter Wöhrle, Michael W. Tausch, Wolf-Dieter Stohrer, Photochemie: Konzepte, Methoden, Experimente, S. 247, Wiley-VCH, Weinheim 1998, ISBN 3-527-29545-3.
- ↑ M. M. Rauhut, Acc. Chem. Res. 2, 1969, S. 80–87.
- ↑ Synthesis and characterisation of an intermediate in the peroxyoxalate chemiluminescence: 4-chlorophenyl O,O-hydrogen monoperoxyoxalate, Cassius V. Stevani, Ivan P. de Arruda Campos, Wilhelm J. Baader, J. Chem. Soc., Perkin Trans. 2, 1996, 1645–1648. doi:10.1039/P29960001645
- ↑ C. V. Stevani, W. J. Baader, Kinetic studies on the chemiluminescent decomposition of an isolated intermediate in the peroxyoxalate reaction. Journal of Physical Organic Chemistry, 10, 1997, S. 593–599. doi:10.1002/(SICI)1099-1395(199708)10:8<593::AID-POC926>3.0.CO;2-H<593::AID-POC926>3.0.CO;2-H
- ↑ a b Gary B. Schuster, Chemiluminescence of Organic Peroxides. Conversion of Ground-State Reactants to Excited-State Products by the Chemically Initiated Electron-Exchange Luminescence Mechanism, Acc. Chem. Research 12, 1979, S. 366–373.
- ↑ A.G. Hadd, A.Seeber and J.W. Birks: Kinetics of Two Pathways in Peroxyoxalate Chemiluminescence, Journal of Organic Chemistry, 65,(2000), 2675-2683.
- ↑ C. Stevani, S. Silva, W. Baader, Studies on the Mechanism of the Excitation Step in Peroxyoxalate Chemiluminescence. European Journal of Organic Chemistry, 2000, 4037–4046 (2000). doi:10.1002/1099-0690(200012)2000:24<4037::AID-EJOC4037>3.0.CO;2-A<4037::AID-EJOC4037>3.0.CO;2-A
- ↑ Kiomars Zargoosh, Mojtaba Shamsipur, Mohammad Qandalee, Mohammad Piltan, Loghman Moradi, Sensitive and selective determination of glucose in human serum and urine based on the peroxyoxalate chemiluminescence reaction of a new Fluorophore, Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 81, 2011, S. 679–683.
- ↑ Juana Cepas, Manuel Silva, Dolores Pérez-Bendito, Evaluation of peroxyoxalate chemiluminescence for the sensitive determination of hallucinogenic alkaloids, Analytica Chimica Acta, 314, 1995, S. 87–94.
- ↑ A.G. Hadd and J.W. Birks, in Selective Detectors: Environmental, Industrial, and Biomedical Applications (Hrsg.): R.E. Sievers. Wiley, New York, 1995, S. 209–239.
- ↑ S. Albrecht, H. Brandl, E. Köstler, Z. Klin. Med. 44, 1989, S. 2071.
- ↑ H. Brandl, S. Albrecht, Praxis Naturwiss. Chem. 39, 1990, S. 17.