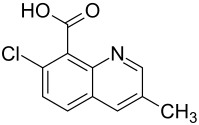
Quinmerac
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Quinmerac | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C11H8ClNO2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, geruchloses Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 221,64 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,49 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
416 °C[1] | ||||||||||||||||||
| Dampfdruck |
6,6·10−12 mbar (20 °C)[2] | ||||||||||||||||||
| Löslichkeit |
sehr schwer löslich in Wasser (0,223 g·l−1)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Quinmerac ist eine chemische Verbindung aus der Gruppe der Chinoline und Carbonsäuren und ein von der BASF 1993 eingeführtes systemisches Herbizid.[3] Ein strukturell verwandtes Mittel ist Quinclorac.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Quinmerac kann durch Reaktion von 7-Chlor-3,8-dimethylchinolin mit N-Bromsuccinimid, Schwefelsäure und Salzsäure gewonnen werden.[4]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Quinmerac wird als Bodenherbizid gegen Problemunkräuter wie Kletten-Labkraut, Ehrenpreisarten und Taubnesseln im Getreide-, Raps- und Zuckerrübenanbau verwendet.[3] Quinmerac ist ein synthetisches Auxin, welche die ACC-Synthase induziert. Dadurch kommt es im Pflanzengewebe vor allem zu einer Anreicherung von dem Pflanzenhormon Abscisinsäure. Dies führt über Blattepinastie, Wachstumsinhibierung der Wurzel und vermehrte Transpiration zum Tod der sensitiven Pflanze.[5]
Zulassung[Bearbeiten | Quelltext bearbeiten]
In Deutschland, Österreich und anderen Staaten der EU sowie in der Schweiz sind Pflanzenschutzmittel mit Quinmerac als Wirkstoff zugelassen.[6]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Britt Leps: Anti-Quinmerac: Einkettenantikörperexpression in transgenen Tabakpflanzen. Dissertation, Martin-Luther-Universität Halle-Wittenberg, 2003. urn:nbn:de:gbv:3-000005961
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j k Eintrag zu 7-Chlor-3-methyl-8-chinolincarbonsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Februar 2023. (JavaScript erforderlich)
- ↑ a b Gückel, W.; Kästel, R.; Kröhl, T.; Parg, A.: Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part IV. An Improved Thermogravimetric Determination Based on Evaporation Rate in Pestic. Sci. 45 (1995) 27–31.
- ↑ a b Eintrag zu Quinmerac. In: Römpp Online. Georg Thieme Verlag, abgerufen am 21. Mai 2014.
- ↑ Thomas A. Unger: Pesticide Synthesis Handbook. William Andrew, 1996, ISBN 0-8155-1853-6, S. 593 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Florene Scheltrup, Klaus Grossmann: Abscisic Acid is a Causative Factor in the Mode of Action of the Auxinic Herbicide Quinmerac in Cleaver (Galium aparine L.). In: Journal of Plant Physiology. Band 147, Nr. 1, Januar 1995, S. 118–126, doi:10.1016/s0176-1617(11)81423-9.
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Quinmerac in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs (Eingabe von „Quinmerac“ im Feld „Wirkstoff“) und Deutschlands, abgerufen am 7. Dezember 2019.