Sasanquin
Zur Navigation springen
Zur Suche springen
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
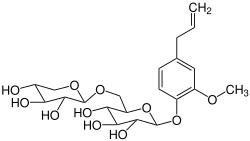
| Name | Sasanquin | |||||||||
| Andere Namen |
Eugenylprimverosid | |||||||||
| Summenformel | C21H30O11 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 458,50 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Sasanquin (Eugenylprimverosid) ist natürlich vorkommendes Glycosid der Primverose mit dem Aglycon Eugenol.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Sasanquin kommt in verschiedenen Arten der Gattung Camellia vor, darunter Camellia sasanqua, Camellia vernalis, Camellia hiemalis und Camellia japonica. Es wurde auch als Marker herangezogen, um taxonomische Einteilungen von Arten und Kultivaren der Gattung Camellia vorzunehmen.[2][3] Daneben kommt es in der Sauerkirsche[4], der Knolligen Kapuzinerkresse[5], Eleutherococcus brachypus aus der Gattung Eleutherococcus[6], Spiraea prunifolia aus der Gattung der Spiersträucher[7] und in Rosa damascena[8] vor.
-
Camellia sasanqua
-
Camellia vernalis
-
Camellia japonica
-
Spiraea prunifolia
-
Rosa damascena
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Sasanquin wirkt gegen eine Zelllinie von Prostatakrebs.[9]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Clifford R Paeks, Katsuhiko Kondo, Tony Swain: Phytochemical Evidence for The Genetic Contamination of Camellia sasanqua Thunberg. In: Japanese Journal of Breeding. Band 31, Nr. 2, 1981, S. 168–182, doi:10.1270/jsbbs1951.31.168.
- ↑ Tadahiro Nagata, Shinsuke Sakai: Caffeine, flavanol and amino acid contentents in leaves of hybrids and species of the section Dubiae in the genus Camellia. In: Japanese Journal of Breeding. Band 35, Nr. 1, 1985, S. 1–8, doi:10.1270/jsbbs1951.35.1.
- ↑ Wilfried Schwab, Gerhard Scheller, Peter Schreier: Glycosidically bound aroma components from sour cherry. In: Phytochemistry. Band 29, Nr. 2, 1990, S. 607–612, doi:10.1016/0031-9422(90)85126-Z.
- ↑ Marco Fuel, Cristina Mesas, Rosario Martínez, Raul Ortiz, Francisco Quiñonero, José Prados, Jesús M. Porres, Consolación Melguizo: Antioxidant and antiproliferative potential of ethanolic extracts from Moringa oleifera, Tropaeolum tuberosum and Annona cherimola in colorrectal cancer cells. In: Biomedicine & Pharmacotherapy. Band 143, November 2021, S. 112248, doi:10.1016/j.biopha.2021.112248.
- ↑ Hao-Bin Hu, Jun Fan: A New Diterpenoid and other Constituents from Acanthopanax Brachypus Harms. In: Journal of the Chinese Chemical Society. Band 56, Nr. 6, Dezember 2009, S. 1186–1190, doi:10.1002/jccs.200900171.
- ↑ Min Hye Yean, Ju Sun Kim, Sam Sik Kang, Yeong Shik Kim: A New Megastigmane Glucoside and Three New Flavonoid Glycosides from Spiraea prunifolia var. simpliciflora. In: Helvetica Chimica Acta. Band 97, Nr. 8, August 2014, S. 1123–1131, doi:10.1002/hlca.201300402.
- ↑ Markus Straubinger, Holger Knapp, Naoharu Watanabe, Noriaki Oka, Hideaki Washio, Peter Winterhalter: Three Novel Eugenol Glycosides From Rose Flowers, Rosa Damascena Mill. In: Natural Product Letters. Band 13, Nr. 1, Februar 1999, S. 5–10, doi:10.1080/10575639908048483.
- ↑ Chun-Chieh Wang, Chi-Tang Ho, Shih-Chieh Lee, Tzong-Der Way: Isolation of eugenyl β-primeveroside from Camellia sasanqua and its anticancer activity in PC3 prostate cancer cells. In: Journal of Food and Drug Analysis. Band 24, Nr. 1, Januar 2016, S. 105–111, doi:10.1016/j.jfda.2015.06.005, PMID 28911392, PMC 9345418 (freier Volltext).




