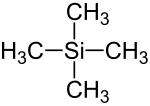
Tetramethylsilan
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetramethylsilan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H12Si | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit charakteristischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 88,23 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,65 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
26 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (20 mg·l−1 bei 25 °C)[1] | |||||||||||||||
| Brechungsindex |
1,3587 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Tetramethylsilan (TMS) ist eine chemische Substanz mit der Konstitutionsformel Si(CH3)4, die aus einem zentralen Silicium-Atom (Si) und vier daran gebundenen Methylgruppen (–CH3) besteht.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Tetramethylsilan lässt sich durch die Grignard-Reaktion aus Siliciumtetrachlorid und Methylmagnesiumchlorid synthetisieren. Es lässt sich auch durch Reaktion von Chlortrimethylsilan mit Natriummethylaluminiumchlorid darstellen.[4]
Eine der ersten Synthesen von Tetramethylsilan gelang 1865 James Mason Crafts und Charles Friedel durch Umsetzung von Siliciumtetrachlorid mit Dimethylzink bei 200 °C.[5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Tetramethylsilan ist eine niedrig siedende farblose Flüssigkeit. Der Siedepunkt unter Normaldruck liegt bei 26 °C.[1] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,97703, B = 1047,272 und C = −36,057 im Temperaturbereich von 208,93 bis 293.64 K.[6] In fester Phase existieren drei polymorphe Kristallformen. Die folgende Tabelle zeigt die Schmelzpunkte, Schmelzenthalpien und Schmelzentropien. Alle Kristallformen stehen monotrop zueinander.[2]
| Polymorphe Formen von Tetramethylsilan[2] | ||||||||||||
| Tf in K | Tf in °C | ΔfH in kJ·mol−1 | ΔfS in J·K−1·mol−1 | |||||||||
| α-Form | 165,92 | −107,23 | 0,703 | 4,24 | ||||||||
| β-Form | 171,02 | −102,13 | 5,878 | 34,37 | ||||||||
| γ-Form | 174,07 | −99,08 | 6,874 | 39,51 | ||||||||
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Tetramethylsilan ist als Flüssigkeit oder Dampf extrem entzündbar. Es bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt unterhalb von −20 °C. Der Explosionsbereich liegt zwischen 1,0 Vol.‑% (36 g/m³) als untere Explosionsgrenze (UEG) und 37,9 Vol.‑% (1385 g/m³) als obere Explosionsgrenze (OEG). Die Grenzspaltweite wurde mit 0,65 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB. Die Zündtemperatur beträgt 330 °C. Der Stoff fällt somit in die Temperaturklasse T2.[1] Tetramethylsilan ist in Wasser nahezu unlöslich.[4]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Als Referenz in der NMR-Spektroskopie[Bearbeiten | Quelltext bearbeiten]
TMS wird in der NMR-Spektroskopie als Standardsubstanz für die Kalibrierung der chemischen Verschiebung von 1H- und 13C-Spektren in organischen Lösungsmitteln verwendet. Dem TMS-Signal wird eine chemische Verschiebung von 0 ppm zugeordnet. Es eignet sich für diesen Zweck aus folgenden Gründen besonders gut:
- TMS liefert in beiden Spektren jeweils ein einziges intensives Signal.
- Das Signal liegt wegen der geringen Elektronegativität von Silicium bei einer niedrigeren Frequenz als die Signale gewöhnlicher organischer Verbindungen.
- TMS ist chemisch weitgehend inert und kann deshalb der Probe als interner Standard zugefügt werden.
- TMS ist leicht flüchtig und kann daher nach der Messung leicht wieder entfernt werden.
Alternativen[Bearbeiten | Quelltext bearbeiten]
In wässrigen Lösungen, in denen TMS quasi unlöslich ist, werden stattdessen die wasserlöslichen Derivate DSS (2,2-Dimethyl-2-silapentan-5-sulfonsäure, Natriumsalz) oder TSP (3-(Trimethylsilyl)-propionsäure, Natriumsalz) verwendet. In organischen Lösungsmitteln kann alternativ zu TMS auch Octamethylcyclotetrasiloxan (OMS) verwendet werden, falls ein höherer Siedepunkt erwünscht ist.
Als Methylierungsmittel[Bearbeiten | Quelltext bearbeiten]
Obwohl TMS – wie oben angegeben – weitgehend inert ist, wurde es erfolgreich als Methylierungsmittel in Transmetallierungsreaktionen eingesetzt:[7]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Die Dämpfe sind reizend für die Augen und die Atemwege, in höheren Konzentrationen besteht eine narkotische Wirkung.
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j k Eintrag zu Tetramethylsilan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Oktober 2021. (JavaScript erforderlich)
- ↑ a b c d e Harada, M.; Atake, T.; Chihara, H.: Thermodynamic properties of polymorphic phases of tetramethylsilane in J. Chem. Thermodyn. 9 (1977) 523–534, doi:10.1016/0021-9614(77)90156-2.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-480.
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 705.
- ↑ J. M. Crafts, C. Friedel: Ueber das Siliciummethyl und die Kieselsäure-Methylather. In: Annalen der Chemie und Pharmacie. Band 136, Nr. 2, 1865, S. 203–211, doi:10.1002/jlac.18651360217.
- ↑ Aston, J.G.; Kennedy, R.M.; Messerly, G.H.: The heat capacity and entropy, heats of fusion and vaporization and the vapor pressure of silicon tetramethyl in J. Am. Chem. Soc. 63 (1941) 2343–2348.
- ↑ H. Schmidbaur, W. Findeiss: A Simple Route to Organogallium Compounds. In: Angewandte Chemie International Edition in English. Band 3, Nr. 10, Oktober 1964, S. 696, doi:10.1002/anie.196406961.




