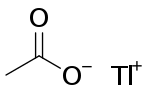
Thallium(I)-acetat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thallium(I)-acetat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H3O2Tl | ||||||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 263,42 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
3,77 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Thallium(I)-acetat ist eine chemische Verbindung des Thalliums aus der Gruppe der Acetate.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Thallium(I)-acetat kann durch die Reaktion von Bariumacetat und Thallium(I)-sulfat in wässriger Lösung[6] oder durch Reaktion von Thallium(I)-hydroxid oder Thallium(I)-carbonat mit Essigsäure hergestellt werden.[7][8] Es entsteht auch bei der Zersetzung von Methylthallium(III)-diacetat.[9]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Thallium(I)-acetat ist ein weißer geruchloser Feststoff, der löslich in kaltem Wasser und wenig löslich in heißem Wasser ist.[3] Es schmilzt bei etwa 130 °C, wobei selbst geringe Verunreinigungen den Schmelzpunkt auf 110 °C senken.[10] Bei höheren Temperaturen zersetzt sich die Verbindung.[11]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Thallium(I)-acetat wird als selektives Mittel gegen gramnegative Bakterien für den Nachweis von Mollicutes verwendet. Es wird auch bei der Herstellung von Thalliumderivaten und bei der Abtrennung von Erzbestandteilen durch die Flotationsmethode eingesetzt.[3] Die Verbindung wurde früher als Medikament zur Behandlung von Ringelflechte und als Bestandteil von Enthaarungscremes verwendet.[5]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f Eintrag zu Thallium(I) acetate, 99.995% (metals basis) bei Thermo Fisher Scientific, abgerufen am 8. Februar 2024.
- ↑ EPA: Toxicological Review of Thallium and compounds, abgerufen am 26. Juli 2023
- ↑ a b c d e Datenblatt Thallium(I) acetate, 99.995% (metals basis) bei Alfa Aesar, abgerufen am 26. Juli 2023 (Seite nicht mehr abrufbar).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Thalliumverbindungen mit Ausnahme der namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. August 2023. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c S. D. Gangolli: The Dictionary of Substances and Their Effects (DOSE). Royal Society of Chemistry, 2007, ISBN 978-1-84755-936-4, S. 163 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Arthur W. Davidson, Walter H. McAllister: Solutions of Salts in Pure Acetic Acid. ii. Solubilities of Acetates 1. In: Journal of the American Chemical Society. Band 52, Nr. 2, 1930, S. 507–519, doi:10.1021/ja01365a010.
- ↑ Datenblatt Thallium(I)-acetat, ≥99% bei Sigma-Aldrich, abgerufen am 25. Juli 2023 (PDF).
- ↑ K. Wade, A. J. Banister: The Chemistry of Aluminium, Gallium, Indium and Thallium. Elsevier Science, 2016, ISBN 978-1-4831-5322-3, S. 1156 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Francis Gordon Albert Stone: Organometallic Chemistry, A Review of the literature published during 1977. Volume 07. Chemical society, 1978, S. 99 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Graham A. Webb: Annual Reports on NMR Spectroscopy. Elsevier Science, 1982, ISBN 978-0-08-058396-9, S. 304 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Patty’s Toxicology, 6 Volume Set. Wiley, ISBN 0-470-41081-7, S. 823 (eingeschränkte Vorschau in der Google-Buchsuche).


