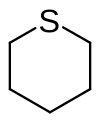
Thian
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thian | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H10S | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 102,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssige bis feste Verbindung | ||||||||||||||||||
| Dichte |
0,99 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
140–142 °C[3] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Brechungsindex |
1,5067 (20 °C)[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Thian, auch Tetrahydrothiopyran genannt, ist der einfachste schwefelhaltige gesättigte sechsgliedrige Heterocyclus.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Thian kann in guter Ausbeute durch die Reaktion von 1,5-Dibrompentan mit Natriumsulfid erhalten werden.[7]
- Reaktion von 1,5-Dibrompentan mit Natriumsulfid zu Thian und Natriumbromid.
Eine weitere Möglichkeit ist die Cyclisierung von 5-Brom-1-pentanthiol in Gegenwart einer Base.[8]
- Reaktion von 5-Brom-1-thiol mit Natriumhydrid unter der Bildung von Thian, Natriumbromid und Wasserstoff.
Außerdem ist die Herstellung durch Reaktion von 1,5-Dichlorpentan mit Natriumsulfid möglich.[9]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Thian kristallisiert im kubischen Kristallsystem mit dem Gitterparameter a = 869 pm und vier Formeleinheiten pro Elementarzelle.[10]
Reaktionen[Bearbeiten | Quelltext bearbeiten]
Thian kann als Nukleophil reagieren, jedoch nur bei guten Abgangsgruppen. Organohalogenide können hierzu mit Silbersalzen aktiviert werden. Hierbei bilden sich sogenannte Tetrahydrothiopyranium-Salze.
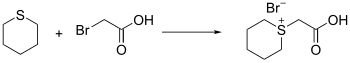
Quellen[Bearbeiten | Quelltext bearbeiten]
- ↑ G. H. Jeffery, R. Parker, A. I. Vogel in: J. Chem. Soc. 1961, 570–574.
- ↑ D. Vedal, O. H. Ellestad, P. Klaboe, G. Hagen in: Spectrochim. Acta Part A 1975, 31, 355–372.
- ↑ R. L. Crumbie, D. D. Ridley in: Aust. J. Chem. 1979, 32, 2777–2781.
- ↑ P. T. White, D. G. Barnard–Smith, F. A. Fidler in: Ind. Eng. Chem. 1952, 44, 1430–1438.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-482.
- ↑ a b Datenblatt Pentamethylene sulfide bei Sigma-Aldrich, abgerufen am 24. April 2011 (PDF).
- ↑ K. Nagasawa, A. Yoneta: Chemistry. II. Use of Dimethyl Sulfoxide – a Facile Synthesis of Cyclic Sulfides in Chem. Pharm. Bull. 1985, 33, 5048–5052, doi:10.1248/cpb.33.5048, pdf.
- ↑ M. B. Anderson, M. G. Ranasinghe, J. T. Palmer, P. L. Fuchs: Cytochalasin support studies. 10. Nucleophilic and electrophilic mercaptanylations via 2-(trimethylsilyl)ethanethiol-derived reagents in: J. Org. Chem. 1988, 53, 3125–3127, doi:10.1021/jo00248a045.
- ↑ Datenblatt 1,5-Dichloropentane, 98% bei Alfa Aesar, abgerufen am 29. Oktober 2018 (Seite nicht mehr abrufbar).
- ↑ S. Kondo in: Bull. Chem. Soc. Jpn. 1956, 29, 999.
- ↑ E. Ziegler, H. Wittmann, H. Sterk in: Monatsh. Chem. 1987, 118, 115–126.




