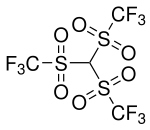
Tris(trifluormethansulfonyl)methan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tris(trifluormethansulfonyl)methan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4HF9O6S3 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 412,23 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser und Diethylether[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Tris(trifluormethansulfonyl)methan ist eine organische Supersäure. Das Anion der Substanz wird als Tris(trifluormethansulfonyl)methid, seltener auch nur als Methid, bezeichnet.
Geschichte[Bearbeiten | Quelltext bearbeiten]
Tris(trifluormethansulfonyl)methan wurde 1988 erstmals von Lutz Turowsky und Konrad Seppelt hergestellt.[1]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Die Synthese von Tris(trifluormethansulfonyl)methan kann aus Trifluormethansulfonylfluorid und Methylmagnesiumchlorid erfolgen. Alternativ kann Bis(trifluormethansulfonyl)methan zuerst mit Methylmagnesiumchlorid und anschließend mit Trifluormethansulfonylfluorid umgesetzt werden.[1] Bis(trifluormethansulfonyl)methan kann ebenfalls mit Trifluormethansulfonsäureanhydrid umgesetzt werden.[5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Die Säurekonstante pKS der Substanz in der Gasphase beträgt ca. −18.[6] Im Anion befindet sich die negative Ladung formal am zentralen Kohlenstoffatom, durch Delokalisierung kann diese aber auf die sechs Sauerstoffatome verteilt werden.[2]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Salze des Tris(trifluormethansulfonyl)methans, die Tris(trifluormethansulfonyl)methide, werden als Katalysatoren eingesetzt. Die Scandium- und Ytterbiumsalze können in Nitrierungen[5], das Ytterbiumsalz in Friedel-Crafts-Acylierungen[7] eingesetzt werden. Das Scandiumsalz und die freie Säure können Ester debenzylieren, das Kupfersalz kann Amide debenzylieren.[8] Methide mit N-Methyl-N-alkyl-pyrrolidinium-Kation (n=1, 2, 3, 4) weisen einen Schmelzpunkt von unter 100 °C auf und werden zu den ionischen Flüssigkeiten gezählt.[9]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Lutz Turowsky, Konrad Seppelt: Tris[(trifluoromethyl)sulfonyl]methane, HC(SO2CF3)3. In: Inorganic Chemistry. Band 27, Nr. 12, 1988, S. 2135–2137, doi:10.1021/ic00285a025.
- ↑ a b Anthony G. M. Barrett, D. Christopher Braddock, Gurubaran S. Raju: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, 2004, ISBN 978-0-470-84289-8, Tris[(trifluoromethyl)sulfonyl]methane and Related Salts, doi:10.1002/047084289x.rn00441.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Tris(trifluoromethanesulfonyl)methane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. Dezember 2021.
- ↑ SynQuest Laboratories: Tris(trifluoromethanesulfonyl)methane. (PDF) Abgerufen am 11. Dezember 2021.
- ↑ a b Francis J. Waller, Anthony G. M. Barrett, D. Christopher Braddock, Dorai Ramprasad, R. Murray McKinnell, Andrew J. P. White, David J. Williams, Richard Ducray: Tris(trifluoromethanesulfonyl)methide (“Triflide”) Anion: Convenient Preparation, X-ray Crystal Structures, and Exceptional Catalytic Activity as a Counterion with Ytterbium(III) and Scandium(III). In: The Journal of Organic Chemistry. Band 64, Nr. 8, 1999, S. 2910–2913, doi:10.1021/jo9800917.
- ↑ Ilmar A. Koppel, Robert W. Taft, Frederick Anvia, Shi-Zheng Zhu, Li-Quing Hu, Kuang-Sen Sung, Darryl D. DesMarteau, Lev M. Yagupolskii, Yurii L. Yagupolskii: The Gas-Phase Acidities of Very Strong Neutral Bronsted Acids. In: Journal of the American Chemical Society. Band 116, Nr. 7, 1994, S. 3047–3057, doi:10.1021/ja00086a038.
- ↑ Anthony G. M. Barrett, D. Christopher Braddock, David Catterick, David Chadwick, Julian P. Henschke, R. Murray McKinnell: Fluorous Biphase Catalytic Friedel-Crafts Acylation: Ytterbium Tris(Perfluoroalkanesulfonyl)methide Catalysts. In: Synlett. Band 2000, Nr. 06, 2000, S. 0847–0849, doi:10.1055/s-2000-6712.
- ↑ Kazuaki Ishihara, Yukihiro Hiraiwa, Hisashi Yamamoto: Homogeneous Debenzylation Using Extremely Active Catalysts: Tris(triflyl)methane, Scandium(III) Tris(triflyl)methide, and Copper(II) Tris(triflyl)methide. In: Synlett. Band 2000, Nr. 01, 2000, S. 80–82, doi:10.1055/s-2000-6436.
- ↑ Katarina M. Johansson, Josefina Adebahr, Patrick C. Howlett, Maria Forsyth, Douglas R. MacFarlane: N-Methyl-N-Alkylpyrrolidinium Bis(perfluoroethylsulfonyl)amide ([NPf2]–) and Tris(trifluoromethanesulfonyl)methide ([CTf3]–) Salts: Synthesis and Characterization. In: Australian Journal of Chemistry. Band 60, Nr. 1, 2007, S. 57–63, doi:10.1071/CH06299.

