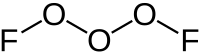
Trisauerstoffdifluorid
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Allgemeines | |||||||
| Name | Trisauerstoffdifluorid | ||||||
| Andere Namen |
| ||||||
| Summenformel | O3F2 | ||||||
| Kurzbeschreibung |
tiefrote Flüssigkeit[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 86,00 g·mol−1 | ||||||
| Aggregatzustand |
flüssig[1] | ||||||
| Dichte |
1,8 g·cm−3 (−190 °C)[1] | ||||||
| Schmelzpunkt |
−190 °C[2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Trisauerstoffdifluorid ist eine anorganische chemische Verbindung des Sauerstoffs aus der Gruppe der Sauerstofffluoride. In neuerer Literatur gilt die Existenz der Verbindung als nicht gesichert.[4] Es wird davon ausgegangen, dass es sich um eine Mischung aus Disauerstoffdifluorid und Tetrasauerstoffdifluorid handelt.[5]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Trisauerstoffdifluorid kann durch Reaktion von Sauerstoff mit Fluor bei etwa −190 °C in einer elektrischen Entladung bei niedrigem Druck gewonnen werden.[1]
Sie wurde erstmals Ende der 1930er-Jahre von den japanischen Wissenschaftlern Aoyama und Sakuraba synthetisiert und untersucht.[6]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Trisauerstoffdifluorid ist ein tiefrote Flüssigkeit, die bei −190 °C erstarrt und zu Unterkühlung neigt. Sie zersetzt sich oberhalb von −157 °C in Sauerstoff und Disauerstoffdifluorid. Sie ist ein starkes Oxidationsmittel, vergleichbar etwa mit Disauerstoffdifluorid und reaktionsfähiger als Fluor und Sauerstoffdifluorid.[1]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 176.
- ↑ Eintrag zu Sauerstoff-Fluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2017.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022567-0, S. 423 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ralf Steudel: Chemie der Nichtmetalle: Von Struktur und Bindung zur Anwendung. Walter de Gruyter, 2008, ISBN 3-11-021128-9, S. 426 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. D. Kirshenbaum, A. V. Grosse: . In: Journal of the American Chemical Society. 81, 1959, S. 1277–1279, doi:10.1021/ja01515a003.
