Van-Slyke-Methode
Die Van-Slyke-Methode ist eine Namensreaktion in der organischen Chemie. Sie ist nach dem US-amerikanischen Biochemiker Donald Van Slyke (1883–1973) benannt, der diese Methode 1910 veröffentlicht hat. Hauptanwendungsbereich ist die quantitative Analyse von α-Aminosäuren durch Messung des entstehenden Stickstoffvolumens.[1]
Übersichtsreaktion[Bearbeiten | Quelltext bearbeiten]
Eine α-Aminosäure reagiert mit Natriumnitrit und Essigsäure zu der entsprechenden α-Hydroxycarbonsäure und reinem Stickstoff sowie Distickstofftrioxid.

Reaktionsmechanismus[Bearbeiten | Quelltext bearbeiten]
Vor der eigentlichen Reaktion wird aus dem Natriumnitrit und der Essigsäure die für den Mechanismus notwendige Salpetrige Säure HNO2 gewonnen, wobei als Nebenprodukte Natriumacetat, Distickstofftrioxid und Wasser entstehen.
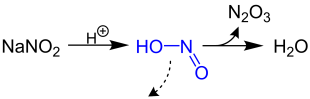
Der vermutete Mechanismus[1] ist folgender. Die Salpetrige Säure reagiert mit der Aminosäure in einem mehrstufigen Vorgang unter zweifacher Abspaltung von Wasser zum entsprechenden Diazoniumsalz 1. In einer anschließenden nukleophilen Substitutionsreaktion (hier SN2, alternativ SN1) wird ein Stickstoffmolekül abgespalten und mit einem Wassermolekül ersetzt. Durch Deprotonierung entsteht so abschließend eine α-Hydroxycarbonsäure 2. Dabei können links- und rechtsdrehende Enantiomere entstehen, wobei für den achiralen Fall R=H aus Glycin Hydroxyessigsäure gebildet wird.

Anwendung[Bearbeiten | Quelltext bearbeiten]
Die Van-Slyke-Methode findet vielfältige Anwendungen in der Analyse von Aminosäuren. Das bei der Reaktion entstehende Distickstofftrioxid wird mithilfe von Permanganat von Stickstoff separiert und anschließend durch Messung des Stickstoffvolumens die Stoffmenge der Aminosäure ermittelt.
Grenzen[Bearbeiten | Quelltext bearbeiten]
Die Messung ist nicht für alle proteinogenen Aminosäuren exakt. Selbst nach 24-stündigem Kochen werden ca. 15 % des Tryptophans nicht erfasst. Zur Analyse schlecht wasserlöslicher Proteine ist die Van-Slyke-Methode nicht besonders gut geeignet.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b Zerong Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Hoboken, New Jersey 2010, ISBN 978-0-470-63885-9, van Slyke Method, S. 2860–2863, doi:10.1002/9780470638859.conrr640.