3-Methoxypropylamin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||||||
| Name | 3-Methoxypropylamin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H11NO | ||||||||||||||||||
| Kurzbeschreibung |
klare gelbliche[1] Flüssigkeit | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 89,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
vollkommen mischbar mit Wasser[1], löslich in Methanol, Aceton, Benzol, Tetrachlormethan, Chloroform[2] | ||||||||||||||||||
| Brechungsindex |
1,4391 (20 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
3-Methoxypropylamin ist ein C3-Amin mit einer endständigen Methoxygruppe. Die Verbindung wird als Korrosionsinhibitor in wässrigen Medien eingesetzt. MOPA eignet sich zur schonenden Entfernung der Boc-Schutzgruppe und als Molekülbaustein für die Synthese des Farbstoffs Disperse Blue 60 und des erst kürzlich in der EU zugelassenen UV-Filters Methoxypropylamino Cyclohexenylidene Ethoxyethylcyanoacetate (S87).[4]
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
Bei der Cyanethylierung von Methanol an Acrylnitril[5] wird praktisch quantitativ 3-Methoxypropionitril gebildet, das an einem Nickel/Kobalt-Kontakt in Gegenwart von überschüssigem Ammoniak zu 3-Methoxypropylamin hydriert werden kann (Ausbeute 96 %).[6]

Die Zugabe von Ammoniak bei der Hydrierung des Nitrils unterdrückt die Bildung des sekundären Amins Bis(3-methoxypropyl)amin.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
3-Methoxypropylamin ist eine klare, farblose bis gelbliche, aminartig riechende Flüssigkeit, die sich vollständig mit Wasser mischt. Eine wässrige Lösung (100 g·l−1) zeigt bei 20 °C einen pH-Wert von 11,5.[1] MOPA ist in einer Vielzahl organischer Lösungsmittel gut löslich.[2] Die Substanz ist hygroskopisch und luftempfindlich.[7]
Anwendungen[Bearbeiten | Quelltext bearbeiten]
3-Methoxypropylamin neutralisiert in Wasser gelöstes und korrosiv wirkendes Kohlendioxid und wird wegen seiner guten Löslichkeit in Wasser und organischen Lösungsmitteln in Funktionsflüssigkeiten, wie z. B. Wärmeträgern, Kühlschmiermitteln, Brems- und Hydraulikflüssigkeiten oder auch bei der Trennung wasserfreier Kohlenwasserstoffmischungen in Raffinerien als Korrosionsinhibitor eingesetzt.[8]
Unlängst wurde die schonende Entfernung der tert-Butyloxy (Boc)-Schutzgruppe von funktionalisierten Heteroaromaten, wie z. B. Indolen, beschrieben.[9]

Die herkömmliche Boc-Abspaltung im Sauren mit z. B. Trifluoressigsäure versagt in diesem Fall.
Der temperaturstabile Dispersionsfarbstoff C.I. Disperse Blue 60[10] ist durch Umsetzung von Bromaminsäure mit Ammoniak und Natriumcyanid zum 1,4-Diamino-2,3-dicyanoanthrachinon[11], anschließende Hydrolyse zum Dicarboximid und Reaktion mit MOPA zugänglich.[12]

Disperse Blue 60 eignet sich zur blauen Einfärbung von Produkten aus thermoplastischen Polymeren, wie z. B. Polyesterfasern.
Durch eine Knoevenagel-Reaktion von 3-Methoxypropylamin mit 1,3-Cyclohexandion entsteht analog zu 1-(2-Ethylhexylamino)-5,5-dimethyl-cyclohexenon-3[13] – aus 2-Ethylhexylamin mit Dimedon (5,5-Dimethylcyclohexan-1,3-dion) – die Ausgangsverbindung 3-(3-Methoxypropylamino)-2-cyclohexen-1-on für den jüngsten im Dezember 2020 von der EU zugelassenen UV-Absorber S87.[14]
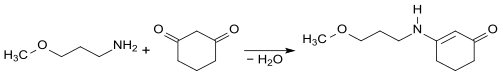
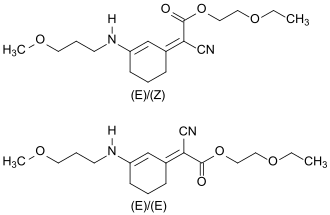
Im finalen Syntheseschritt wird in einer weiteren Knoevenagel-Reaktion die zweite Carbonylgruppe der Vorstufe zunächst mit Diethylsulfat zum Enolether und anschließend mit 2-Ethoxyethylcyanacetat zum Methoxypropylamino Cyclohexenylidene Ethoxyethylcyanoacetate (S87) umgesetzt.[15]

Das Absorptionsmaximum λmax des in Sonnenschutzmitteln bis zu einer Konzentration von 3 % zugelassenen UV-Absorbers S87 liegt im UV-A-Bereich bei 385 nm.
Die Verbindung fällt bei der Synthese als (Z)-Isomer an und isomerisiert in Lösung innerhalb von fünf Stunden zu einem Gemisch von ca. 60 % (Z)-Isomer und ca. 40 % (E)-Isomer.[4]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i Eintrag zu 3-Methoxypropylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ a b c d William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–352.
- ↑ Datenblatt 3-Methoxypropylamin bei Sigma-Aldrich, abgerufen am 18. April 2021 (PDF).
- ↑ a b VERORDNUNG (EU) 2020/1684 DER KOMMISSION. Europäische Kommission, 12. November 2020, abgerufen am 20. April 2021.
- ↑ Patent US3253040: Process for the production of primary 3-hydroxycarbyloxypropylamines. Angemeldet am 10. Dezember 1962, veröffentlicht am 24. Mai 1966, Anmelder: Union Carbide Corp., Erfinder: G.H. Potter, R.C. Myerly.
- ↑ Patent DE2121325C2: Verfahren zur Herstellung von Methoxypropionitril. Angemeldet am 30. April 1971, veröffentlicht am 9. November 1972, Anmelder: BASF AG, Erfinder: M. Decker, H. Hoffmann, K. Merkel.
- ↑ Datenblatt 3-Methoxpropylamine, 99% bei Alfa Aesar, abgerufen am 20. April 2021 (Seite nicht mehr abrufbar).
- ↑ Patent US4229284: Corrosion control method using methoxypropylamine (mopa) in water-free petroleum and petrochemical process units. Angemeldet am 15. Mai 1978, veröffentlicht am 21. Oktober 1980, Anmelder: Nalco Chemical Co., Erfinder: J.A. White, T.C. Maynard.
- ↑ Z.Z. Gulledge, J.D. Carrick: Deprotonation of N-tert-butoxycarbonyl (Boc)protected functionalized heteroarenes via addition-elimination with 3-methoxypropylamine. In: Eur. J. Org. Chem. Band 12, 2020, S. 1817–1822, doi:10.1002/ejoc.201901811.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Disperse Blue 60: CAS-Nummer: 12217-80-0, EG-Nummer: 235-402-7, ECHA-InfoCard: 100.032.172, PubChem: 25530, ChemSpider: 23816, Wikidata: Q72469713.
- ↑ Patent EP0034257A2: Verfahren zur Herstellung von 1,4-Diamino-2,3-dicyanoanthrachinon. Angemeldet am 17. Januar 1981, veröffentlicht am 26. August 1981, Anmelder: Bayer AG, Erfinder: F.W. Kröck, R. Neef.
- ↑ Patent US2628963: 1,4-Diamino-2,3-anthraquinone-dicarboximides. Angemeldet am 5. Dezember 1951, veröffentlicht am 17. Februar 1953, Anmelder: E.I. du Pont de Nemours & Co., Erfinder: J.F. Laucius, S.B. Speck.
- ↑ Patent US4749643: Photographic recording element containing a UV absorbant and a silver halide emulsion layer. Angemeldet am 21. August 1986, veröffentlicht am 7. Juni 1988, Anmelder: Agfa Gevaert AG, Erfinder: H. Öhlschläger, H. Langen, J. Sobel.
- ↑ B. Winkler, H.-W. Hoeffken, K. Eichin, W. Houy: A cyclic merocyanine UV-A absorber: mechanism of formation and crystal structure. In: Tetrahedron Lett. Band 55, Nr. 10, 2014, S. 1749–1771, doi:10.1016/j.tetlet.2014.01.113.
- ↑ Patent EP2734499B1: Merocyaninderivate. Angemeldet am 19. Juli 2012, veröffentlicht am 24. Juni 2020, Anmelder: BASF SE, Erfinder: B. Winkler, D. Hüglin, K. Eichin, L. Ehrsam, X. Marat, H. Richard, I.M. Kienzle, U. Schröder.


