Vinylencarbonat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Vinylencarbonat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H2O3 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 86,05 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,355 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
162 °C[1] | |||||||||||||||
| Brechungsindex |
1,421 (20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−459,9 kJ/mol[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vinylencarbonat oder 1,3-Dioxol-2-on, kurz VC, ist der einfachste ungesättigte cyclische Kohlensäureester. Vinylencarbonat kann auch als cyclisches Carbonat des hypothetischen (Z)-Ethen-1,2-diols aufgefasst werden. Die aktivierte Doppelbindung in diesem fünfgliedrigen sauerstoffhaltigen Heterocyclus macht das Molekül zu einem reaktiven Monomer für die Homopolymerisation und Copolymerisation und zu einem Dienophil in Diels-Alder-Reaktionen. Vinylencarbonat ist in hochreiner Form unterhalb Raumtemperatur ein farbloser stabiler Feststoff.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Ethylencarbonat ist seit der ersten Beschreibung im Jahr 1953[3] das gängige Ausgangsmaterial für Vinylencarbonat. In einer UV-initiierten Photochlorierungs-Reaktion mit Chlor oder Sulfurylchlorid bei 60–70 °C in Substanz entsteht in der ersten Stufe Monochlorethylencarbonat, das in der zweiten Stufe durch Dehydrochlorierung, z. B. mit Triethylamin, ggf. verdünnt mit Ethylencarbonat,[4] Vinylencarbonat[5] oder MTBE,[6] bei 40–60 °C in Vinylencarbonat überführt wird.
Statt in flüssiger Phase kann die Dehydrochlorierung auch in der Gasphase an einem mit Zinkchlorid imprägnierten Kontakt in einem Wirbelbettreaktor bei 350–500 °C mit durchschnittlichen Ausbeuten von 69 % d.Th. durchgeführt werden.[7] Der einfach erscheinende Reaktionsweg liefert wegen einer Vielzahl von Nebenreaktionen lediglich Ausbeuten von 70 bis 80 % d.Th. an unreinem Endprodukt. So entstehen bei der Chlorierung von Ethylencarbonat in Substanz oder Lösung u. a. 2-Chloracetaldehyd, mehrfach chlorierte Ethylencarbonate und unter Ringöffnung weitere chlorhaltige Verbindungen, deren Abtrennung aus dem Endprodukt durch Destillation mittels Dünnschichtverdampfer,[4] mittels fraktionierter Umkristallisation[8] oder Zonenschmelzen[9] sehr aufwendig ist. Der Gehalt an Nebenprodukten kann auch durch Rühren mit Natriumborhydrid[10] oder Harnstoff[11] bei erhöhter Temperatur vermindert werden. Problematisch ist auch die ausgeprägte Thermolabilität von VC, das sich bei Temperaturen oberhalb 80 °C innerhalb von Minuten zersetzt.[4] Hochreines Vinylencarbonat kann durch Optimierung der Chlorierungsbedingungen zur Unterdrückung der Bildung von Nebenprodukten[6] und einer Kombination mehrerer schonender Reinigungsverfahren in Ausbeuten über 70 % d.Th. erhalten werden.[12] Die Polymerisationsneigung des flüssigen VC wird durch Zugabe von Inhibitoren, wie z. B. Butylhydroxytoluol (BHT), unterdrückt.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Vinylencarbonat fällt bei der industriellen Herstellung meist als gelbe bis braune Flüssigkeit an. Durch geeignete Prozessführung und Reinigungsschritte kann ein bei 20–22 °C schmelzender Feststoff mit Chlorgehalten unter 10ppm erhalten werden. Flüssiges VC färbt sich auch bei Lichtausschluss schnell gelb und muss durch Zugabe von Radikalfängern stabilisiert werden. In fester Form ist die hochreine Substanz bei Lagerung unterhalb 10 °C langzeitstabil.[13] Vinylencarbonat löst sich in einer Vielzahl von Lösungsmitteln, wie Ethanol, Tetrahydrofuran, Ethylencarbonat, Propylencarbonat und anderen dipolar aprotischen Elektrolyt-Lösemitteln für wiederaufladbare Lithium-Ionen-Akkumulatoren, wie Dimethylcarbonat, Diethylcarbonat u. ä.
Verwendung[Bearbeiten | Quelltext bearbeiten]
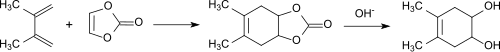
Bereits in der ersten Publikation über Vinylencarbonat[3] wurden Diels-Alder-Reaktionen am Beispiel der Addition an 2,3-Dimethylbutadien zum bicyclischen Carbonat und nachfolgender Hydrolyse zum cis-4,5-Dihydroxy-1,2-cyclohexen beschrieben.
Mit Cyclopentadien als Dien entsteht nach Hydrolyse das vicinale Norbornendiol Bicyclo[2.2.1]hept-5-en-2,3-diol. Die Swern-Oxidation zum 1,2-Keton Bicyclo[2.2.1]hept-5-en-2,3-dion verläuft in der Variante mit Trifluoressigsäureanhydrid statt Oxalylchlorid mit einer Ausbeute von 73 % d.Th.[14]
Unter UV-Bestrahlung reagieren Ketone mit Vinylencarbonat unter Bildung bicyclischer exo-Oxetane.
Mit Phosphor(V)-sulfid reagiert Vinylencarbonat zum entsprechenden Vinylenthionocarbonat (2-Thiono-1,3-dioxol-4-en)[15] das bei UV-Bestrahlung in quantitativer Ausbeute Keten liefert. Die Reaktion stellt eine gute Alternative zur Zersetzung von α-Diazoketonen dar.[16]
Größeren Einsatz findet Vinylencarbonat als Elektrolytzusatz für Lithiumionenbatterien, der die Ausbildung eines im Elektrolyten unlöslichen Films als fester Grenzfläche zwischen negativer Elektrode und dem Elektrolyten (SEI, solid electrolyte interphase) fördert.[17] Dieser Polymerfilm ermöglicht die Ionenleitung, verhindert aber die Reduktion des Elektrolyten an der negativen (Graphit-)Elektrode und trägt wesentlich zur Langzeitstabilität von Lithiumionenbatterien bei.[18][19]
Veröffentlichungen jüngster Zeit lassen vermuten, dass das cyclische Sulton 3-Fluor-1,3-propansulton (FPS) dem Vinylencarbonat überlegene Eigenschaften als SEI-Bildner besitzt.[20]
Da das dem FPS zugrundeliegende 1,3-Propansulton als besonders gefährlicher krebserzeugender Stoff eingestuft ist, muss auch bei FPS von einem erheblichen Gefährdungspotenzial ausgegangen werden.
Polymere[Bearbeiten | Quelltext bearbeiten]
Bereits die erste Arbeit über Vinylencarbonat[3] beschreibt die Substanzpolymerisation zu farblosen Polymeren, die nach Hydrolyse wasserlöslich waren. Spätere Publikationen[21][22] legen die Vermutung nahe, dass die ersten Autoren lediglich Oligomere mit niedriger molarer Masse hergestellt hatten. Entscheidend für die Herstellung von Polymeren mit höherer Molmasse und brauchbaren Eigenschaften ist die Reinheit des monomeren Vinylencarbonats.[23] Vinylencarbonat kann in Substanz, in Lösung, in Suspension und in Dispersion mithilfe von Radikalstartern, wie z. B. Azobis(isobutyronitril) (AIBN) oder Benzoylperoxid, homopolymerisiert oder mit anderen Vinylmonomeren, wie Vinylpyrrolidon oder Vinylpropionat, copolymerisiert werden.[24]
Polyvinylencarbonat ist gut löslich in Aceton und Dimethylformamid. Die erhaltenen Lösungen neigen allerdings bereits bei Raumtemperatur zur Zersetzung.[25] In der Patentliteratur sind zugfeste Fasern, klare, farblose und mechanisch belastbare Folien,[21][10] Membranen zur Umkehrosmose,[26] sowie Träger für die Affinitätschromatographie[27] aus Polyvinylencarbonat beschrieben.
Problematisch ist neben der Instabilität in Lösungen die Hydrolyseneigung des Polyvinylencarbonats bereits in schwach alkalischem Milieu. Dabei entsteht durch Aufspaltung des cyclischen Carbonatrings Polyhydroxymethylen (PHM) mit der Wiederholungseinheit –(CHOH)–, dessen Verhalten viel mehr der Cellulose ähnelt als dem verwandten Polyvinylalkohol mit der Wiederholungseinheit –(CH2–CHOH)–.
So sind Folien aus Polyhydroxymethylen, die durch alkalische Hydrolyse von Polyvinylencarbonat-Folien mittels Natriummethanolat in Methanol erhalten werden, kristallin und zeigen hohe Zugfestigkeiten.[10] Analog zu Cellulose kann Polyhydroxymethylen in heißer Natronlauge gelöst und durch Vernetzung in ein stark quellfähiges Polymer übergeführt werden, das bis zum 10,000-fachen seines Gewichts an Wasser aufnehmen kann.[28] Polyhydroxymethylen ist in wasserfreiem Hydrazin löslich[29] und kann durch Verspinnen in Wasser in celluloseartige Fasern überführt werden. Ähnlich wie Cellulose reagiert Polyhydroxymethylen mit Schwefelkohlenstoff im Alkalischen zu einem Xanthogenat, aus dem durch Fällung in verdünnter Schwefelsäure wieder wasserunlösliches Polyhydroxymethylen erhalten wird.[30]
Das Fehlen neuerer Literatur, insbesondere Patentliteratur, über Poly-VC und PHM legt nahe, dass die Eigenschaften der erhaltenen Homo- und Coolymeren und die daraus hergestellten Formteile die darin gesetzten Erwartungen nicht erfüllen konnten.
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Vinylencarbonat erfordert wegen seines problematischen toxikologischen und ökotoxikologischen Profils[1] und seiner potenziell karzinogenen Eigenschaften[31] besondere Vorsicht bei der Handhabung.
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j Datenblatt Vinylene carbonate bei Sigma-Aldrich, abgerufen am 22. Dezember 2013 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- ↑ a b c M. S. Newman, R. W. Addor: Vinylene Carbonate. In: Journal of the American Chemical Society. Band 75, Nr. 5, 1953, S. 1263–1264, doi:10.1021/ja01101a526.
- ↑ a b c Patent US6395908: Process for the preparation of vinylene carbonate, and the use thereof. Veröffentlicht am 28. Mai 2002, Anmelder: Merck Patentgesellschaft, Erfinder: B. Seifert et al..
- ↑ Patent EP1881972: Process for producing vinylene carbonate. Veröffentlicht am 28. August 2013, Anmelder: Saltigo GmbH, Erfinder: Reinhard Langer, Anke Beckmann, Paul Wagner, Heinrich Grzinia, Marielouise Schneider, Ulrich Notheis, Lars Rodefeld, Nikolaus Müller.
- ↑ a b Patent US8022231: Process for preparing monochloroethylene carbonate and subsequent conversion to vinylene carbonate. Veröffentlicht am 20. September 2011, Anmelder: Evonik Degussa GmbH, Erfinder: M. Lerm et al..
- ↑ Patent EP1881973: PROCESS FOR PRODUCING VINYLENE CARBONATE. Veröffentlicht am 30. Januar 2008, Erfinder: R. Langer et al..
- ↑ Patent GB899205: The purification and polymerisation of vinylene carbonate. Veröffentlicht am 20. Juni 1962, Anmelder: ICI Ltd., Erfinder: B.F. Nesbitt, I. Goodman.
- ↑ Morris Zief, Hollister Ruch, Charles H. Schramm: Low temperature zone refining apparatus. In: Journal of Chemical Education. Band 40, Nr. 7, 1963, S. 351, doi:10.1021/ed040p351.
- ↑ a b c N. D. Field, J. R. Schaefgen: High molecular weight poly(vinylene carbonate) and derivatives. In: Journal of Polymer Science A: Polymer Chemistry. Band 58, Nr. 166, 1962, S. 533–543, doi:10.1002/pol.1962.1205816630.
- ↑ PCT-Anmeldung WO 2006/119910, Verfahren zur Reinigung von Vinylencarbonat, Erfinder: R. Langer et al., Anmelder: Lanxess Deutschland GmbH, veröffentlicht am 16. November 2006.
- ↑ Patent EP1881971: High-purity vinylene carbonate and a method of purifying vinylene carbonate. Veröffentlicht am 30. Januar 2008, Anmelder: Saltigo GmbH, Erfinder: Reinhard Langer, Paul Wagner, Heinrich Grzinia.
- ↑ Patent WO2006119908: METHOD OF STORING AND TRANSPORTING VINYLENE CARBONATE. Veröffentlicht am 16. November 2006, Anmelder: Lanxess Deutschland GmbH, Erfinder: R. Langer.
- ↑ T. Kobayashi, S. Kobayashi: Swern Oxidation of Bicyclo[2.2.1]hept-5-ene-2,3-diol and Its Pyrazine-fused Derivatives: An Improved Synthesis of Bicyclo[2.2.1]hept-5-ene-2,3-dione and An Unexpected Ring-Opening Reaction. In: Molecules. Band 5, Nr. 9, 2000, S. 1062–1067, doi:10.3390/50901062.
- ↑ Hans-Michael Fischler, Willy Hartmann: Notiz über die Darstellung von Vinylenthioncarbonat und einigen alkyl- sowie arylsubstituierten Derivaten. In: Chemische Berichte. Band 105, Nr. 8, 1972, S. 2769–2771, doi:10.1002/cber.19721050838.
- ↑ Handbook of Reagents for Organic Syntheses, Sulfur-Containing Reagents, ed. L.A. Paquette, Wiley-VCH, 2010, ISBN 978-0-470-74872-5, S. 535.
- ↑ Hsiang-Hwan Lee, Yung-Yun Wang, Chi-Chao Wan, Mo-Hua Yang, Hung-Chun Wu, Deng-Tswen Shieh: The function of vinylene carbonate as a thermal additive to electrolyte in lithium batteries. In: Journal of Applied Electrochemistry. Band 35, Nr. 6, 2005, S. 615–623, doi:10.1007/s10800-005-2700-x.
- ↑ M. Broussely et al., Main aging mechanisms in Li ion batteries, J. Power Sources, 146 (1), 90–96 (2005), doi:10.1016/j.jpowsour.2005.03.172.
- ↑ Patent DE102004018929: Elektrolytzusammensetzung sowie deren Verwendung als Elektrolytmaterial für elektrochemische Energiespeichersysteme. Veröffentlicht am 17. November 2005, Anmelder: Anmelder Degussa AG, Erfinder: V. Hennige et al..
- ↑ H.M. Jung et al., Fluoropropane sultone as an SEI-forming additive that outperforms vinylene carbonate, J. Mater. Chem. A, 1, 11975–11981 (2013), doi:10.1039/C3TA12580G.
- ↑ a b Patent US2993030: Process for polymerizing vinylene carbonate. Veröffentlicht am 16. Juli 1961, Anmelder: J.T. Baker Chemical Co., Erfinder: G.E. Ham, M. Zief.
- ↑ M. Krebs, C. Schneider, Vinylene carbonate – A study of its polymerization and copolymerization behavior, Adv. Chem., 142 (9), 92–98 (1975), doi:10.1021/ba-1975-0142.ch009.
- ↑ Patent GB899205: The purification and polymerisation of vinylene carbonate. Veröffentlicht am 20. Juni 1962, Anmelder: Imperial Chemical Industries Ltd, Erfinder: Brenda Frances Nesbitt, Isaac Goodman.
- ↑ Patent US4098771: Process for the preparation of polymers of vinylene carbonate. Veröffentlicht am 4. Juli 1978, Anmelder: Hoechst AG, Erfinder: H. Huemer, K. Burg.
- ↑ J. Huang et al., Investigations on vinylene carbonate I. Preparation and properties of poly-(vinylene carbonate), Chinese J. Polym. Sci., 8(3), 197–203 (1990).
- ↑ Patent US3332894: Polyvinyl carbonate desalination membrane and a method of producing the same. Veröffentlicht am 25. Juli 1967, Erfinder: P.A. Cantor, R.E. Kesting.
- ↑ Patent US4788278: Polyvinylene carbonate and polyhydroxymethylene, processes for their preparation and their use. Veröffentlicht am 29. November 1988, Anmelder: Hoechst AG, Erfinder: O. Mauz.
- ↑ Patent US4061692: Process for the manufacture of swellable, absorptive polymers of polyhydroxy methylene. Veröffentlicht am 6. Dezember 1977, Erfinder: A. Holst, M. Kostrzewa.
- ↑ Patent US4076680: Poly(hydroxymethylene) solutions. Veröffentlicht am 28. Februar 1978, Erfinder: M.K. Akkapeddi, H.K. Reimschuessel.
- ↑ Patent US3331800: Preparation of solutions of polyhydroxymethylene-containing polymers. Veröffentlicht am 18. Juli 1967, Erfinder: H. Schübel et al..
- ↑ Eintrag zu Vinylene Carbonate bei TCI Europe, abgerufen am 5. Januar 2014.